近期,南京财经大学汤晓智教授、冯潇副教授在国际食品TOP期刊Food Hydrocolloids (Q1, IF=11.0)发表题目为“Bromelain hydrolysis and CaCl2 coordination promote the fibrillation of quinoa protein at pH 7”的研究性论文。

成果亮点:
1. 酶水解促进pH 7下纤维聚集体的形成。
2. 水解引起的蛋白间静电斥力的增强促进了纤维化。
3. CaCl2促进热不可逆蛋白纤维的形成并且延长其长度。
4. 更长的纤维聚集体有助于提高藜麦蛋白的凝胶性。
研究背景:
近年来,随着人们健康饮食意识的提高及可持续发展的趋势,植物蛋白在食品中的应用越来越广泛。凝胶性是蛋白质重要的功能特性之一,但是大多数植物蛋白的凝胶性较弱,形成凝胶强度较低且持水力差,限制了藜麦蛋白在食品加工领域中的应用。蛋白的凝胶化通常是由蛋白质的展开和随后的聚集引起的,纤维聚集和颗粒聚集是两种主要的聚集方式。蛋白质的纤维聚集具有各向异性的线性结构,该结构为蛋白质相互交联提供了更多的区域,从而形成具有均匀孔隙分布的网络结构,并提高蛋白凝胶的凝胶强度。目前纤维聚集体的形成主要是在pH 2条件下,在中性条件下蛋白加热主要形成的是颗粒聚集体。然而,在强酸条件下形成的纤维聚集体的结构易受到pH变化的影响而不适用于食品体系中。目前,在中性条件下促进纤维化的报道有限。因此,本文通过菠萝蛋白酶水解及CaCl2的配位作用,提高了藜麦分离蛋白(QPI)纤维化的能力,有效改善了藜麦蛋白的凝胶性,有助于扩大藜麦蛋白在食品产业中的应用。
主要内容:
藜麦蛋白具有较高的营养价值,含有所有必需氨基酸,但是较弱的凝胶性限制了其加工和应用。在pH 2条件下形成的植物蛋白的纤维聚集体可以改善凝胶性,但是蛋白纤维会随着pH的变化而分解。我们发现中性条件下蛋白酶水解藜麦分离蛋白可以代替酸水解、并在热诱导后形成纤维聚集体。当酶底比(E/S)增大到0.075%时,蛋白间静电斥力增加,但是疏水相互作用无显著性变化,这两种分子间驱动力的协同作用有利于纤维聚集体的形成。然而,E/S的持续增加导致纤维聚集体减少,这是因为静电斥力降低、疏水相互作用增加加快了聚集速率。当E/S为0.075%时,随着CaCl2浓度从0增加到120 mmol/L,平行β-折叠含量增加,纤维聚集体长度从175 nm增加到327 nm。Ca2+与羧基之间为桥接配位模式。然而,当CaCl2浓度增加到160和200 mmol/L时,由于静电屏蔽作用,纤维聚集体团聚并变短,导致凝胶性降低。我们提出了一种在中性条件下制备QPI纤维聚集体的创新方法,揭示限制性菠萝蛋白酶水解及适当浓度的CaCl2配位可以通过调节蛋白纤维化程度而改善藜麦蛋白的凝胶性。
图文赏析:
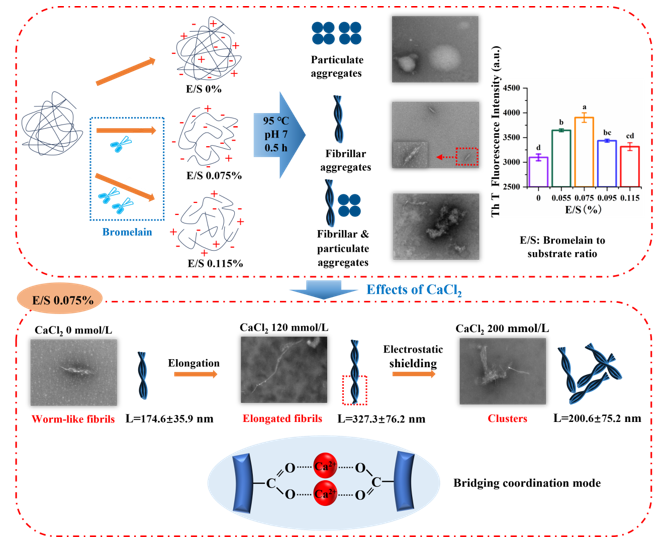
Fig. 1. Graphical abstract.
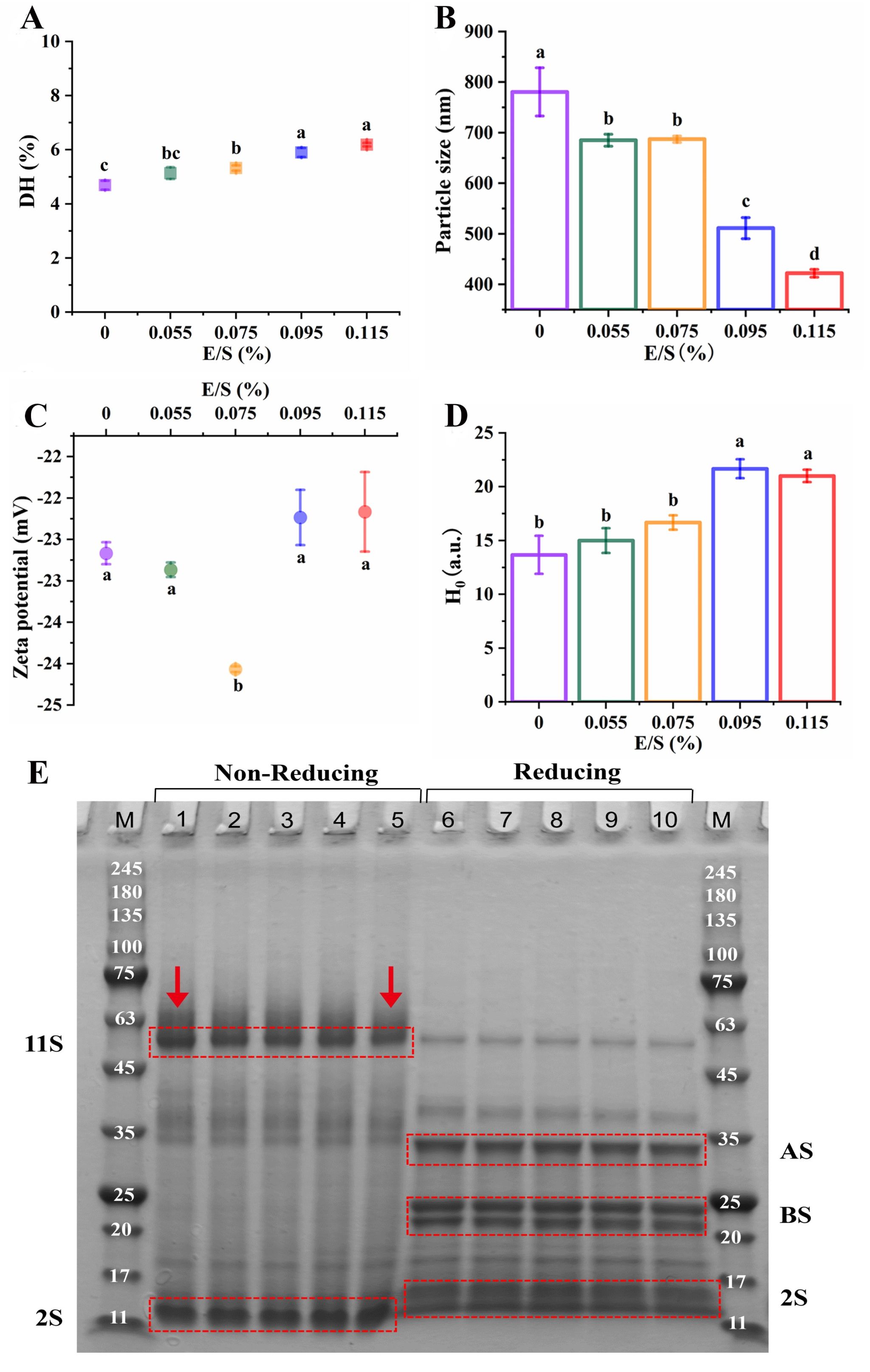
Fig. 2. Effects of E/S on the physicochemical properties of QPI. (A) DH, (B) Particle size, (C) Zeta potential, (D) Surface hydrophobicity (H0), (E) Protein composition.
*M indicates Marker. 1, 2, 3, 4, 5 indicate QPI hydrolyzed with various enzyme to substrate ratio of 0%, 0.055%, 0.075%, 0.095%, 0.115%, respectively, under non-reducing condition. 6, 7, 8, 9, 10 indicate QPI hydrolyzed with various enzyme to substrate ratio of 0%, 0.055%, 0.075%, 0.095%, 0.115%, respectively, under reducing condition.
DH indicates the degree of hydrolysis.
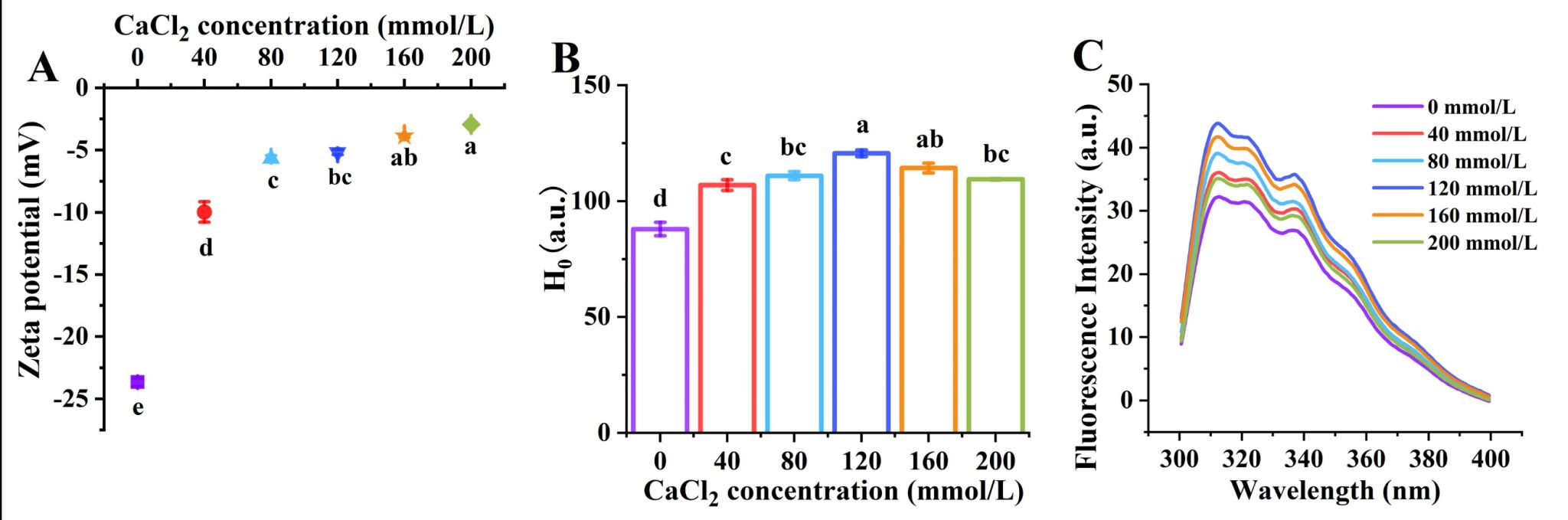
Fig. 3. Effects of CaCl2 concentration on the zeta potential (A), surface hydrophobicity (B) and intrinsic fluorescence intensity (C) of QPI aggregates.
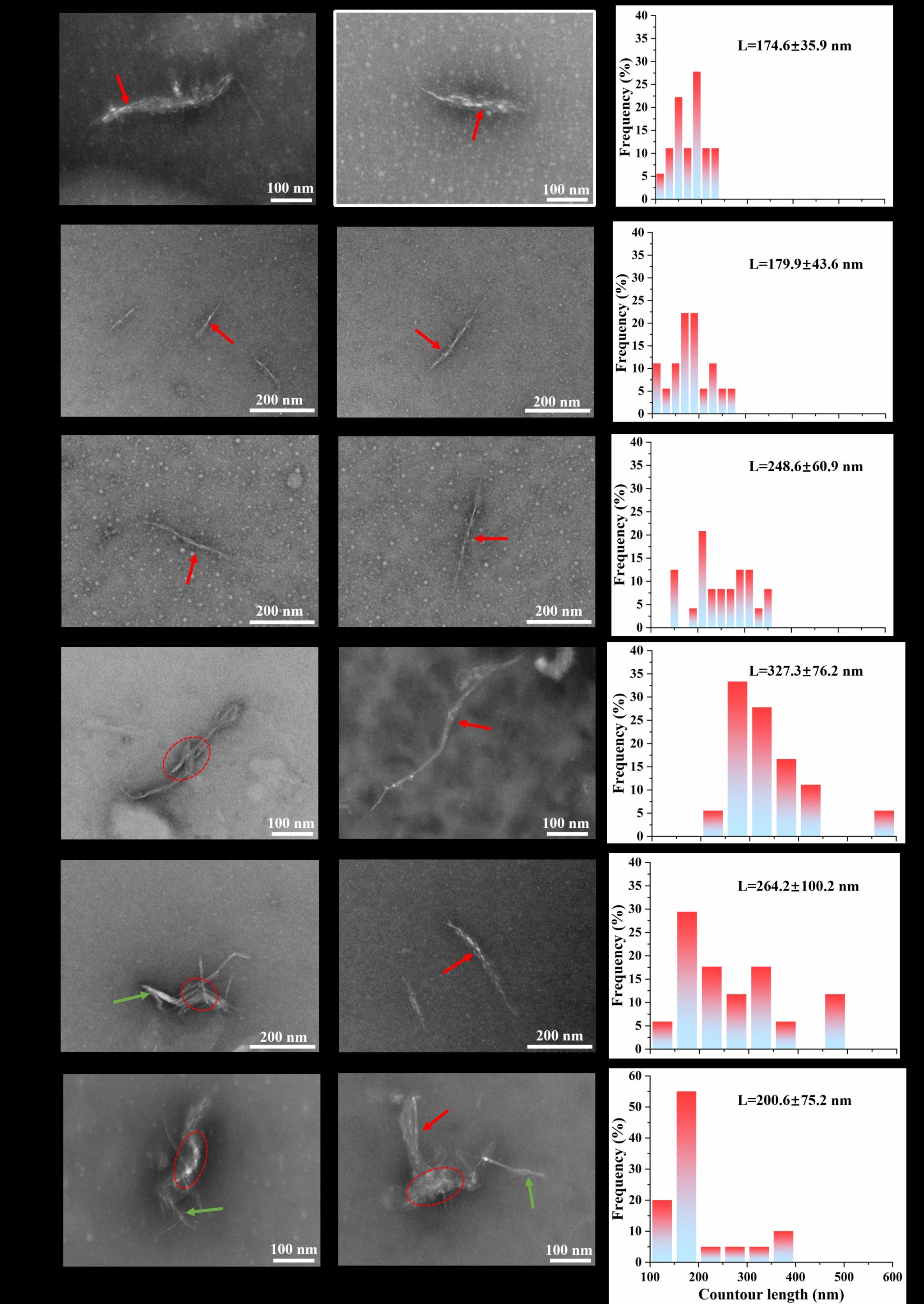
Fig. 4. Morphology of QPI aggregates with different CaCl2 addition: A 0 mmol/L, B 40 mmol/L, C 80 mmol/L, D 120 mmol/L, E 160 mmol/L, F 200 mmol/L.
E/S indicates enzyme to substrate ratio.
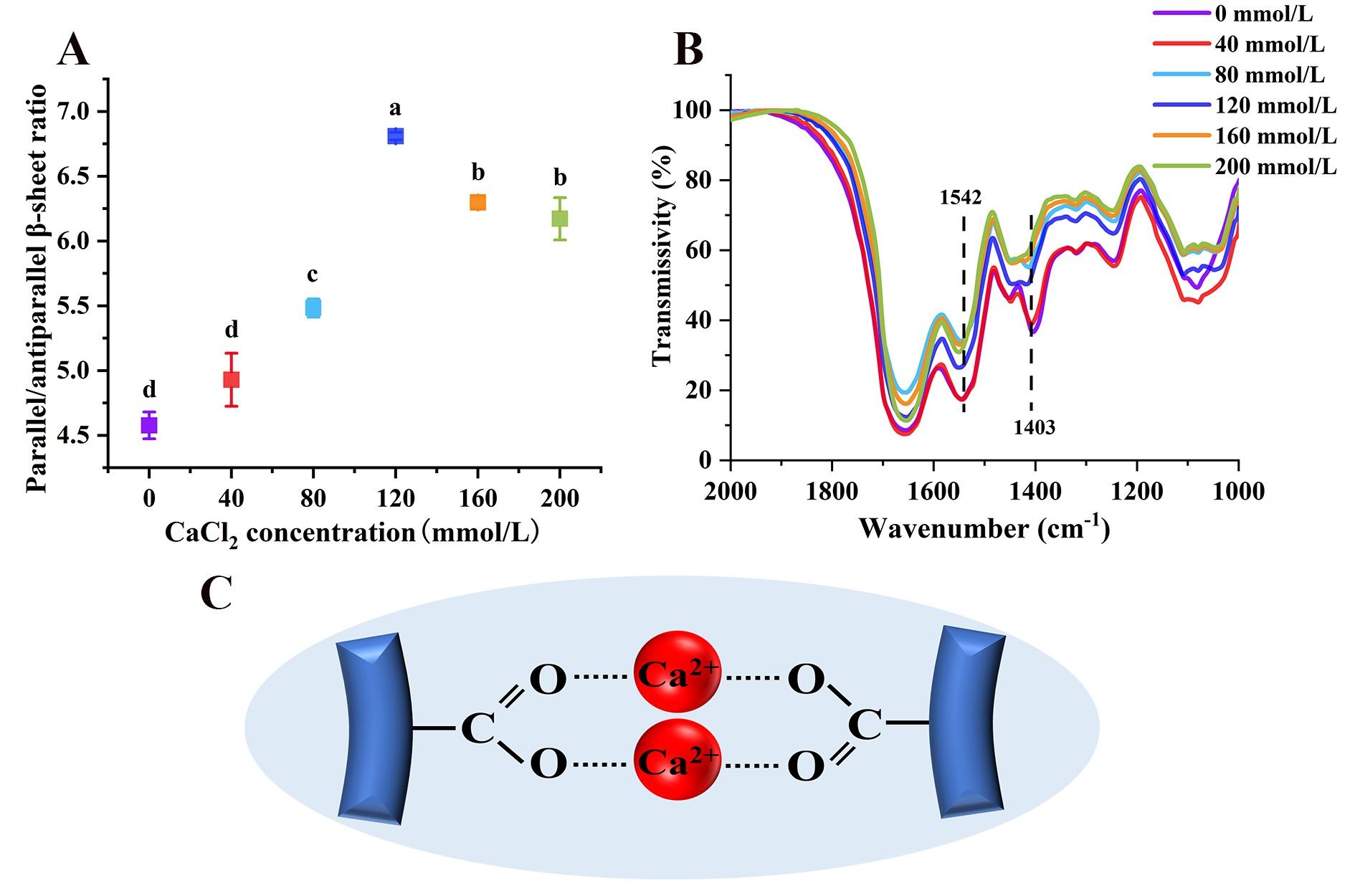
Fig. 5. (A) Effects of CaCl2 concentration on the parallel/anti-parallel β-sheet ratio of QPI aggregates. (B) The FTIR spectrum of QPI aggregates at different CaCl2 concentrations. (C) Bridging coordination mode between carboxyl groups and Ca2+
原文链接:https://doi.org/10.1016/j.foodhyd.2024.110659